【化学基礎】溶液の濃度【授業実践備忘録】
さて、今回は溶液の濃度についての授業実践についてつらつらと。
高校化学では溶液を使った反応を扱うことが多く、molを使って量的な関係を考えることが中心になっています。
それで、molを使って濃度を考えることが重要になってくるわけです。
溶質・溶媒・溶液
中学校1年の理科で水溶液の性質についてすでに学んでいます。
私が溶液の濃度の授業をする際、導入として必ず、溶質・溶媒・溶液および溶解といった用語の定義の確認をします。
その際、食塩が水に溶けて食塩水になることを例にして、食塩・水・食塩水はそれぞれ「溶◯」というか?といった問いかけをします。
こうすると生徒の食いつきがよく、自然と近くの生徒どうしで相談するようになります。

質量パーセント濃度とモル濃度
中学校1年の理科と数学の授業で質量パーセント濃度についてはすでに学んでいます。
この質量パーセント濃度が中学校の頃苦手だったという生徒が多く、特に数学で「◯%の食塩水△gと、▢%の食塩水☆gを混ぜたら何%になるか?」という問題で苦労したという話をしばしば耳にしています。
質量%濃度の式を示した後に問題演習を行うと、分母には溶液の質量を当てはめるべきところを、溶媒の質量と間違えてしまう生徒がたびたび見られました。
質量パーセント濃度の公式提示と問題演習を行った後は、モル濃度について触れます。
正式にはモル濃度は「体積モル濃度」といい、溶液1Lに含まれる溶質の物質量で定義をされます。
(※上位科目の「化学」で「質量モル濃度」について扱います)
この溶液の濃度以前に物質量について授業をしていますが、溶液の体積と気体の体積の換算がごっちゃになって、溶液の体積に22.4Lという数値を掛けてしまう生徒もわずかながらいました。

濃度の単位の換算
※濃度の単位の換算については、学力が下位層の授業では省略することもあります。
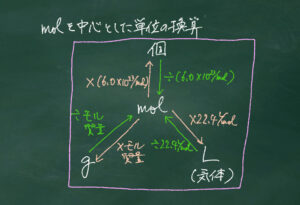
質量パーセント濃度もモル濃度もそれぞれ分母が溶液の量、分子が溶質の量であることが共通しています。
そこで、下の板書画像に示したフレームを使うと、溶液・溶質ごとに単位の換算が実は用意になったりします。
ポイントは溶液1Lを基準に考えることです。
溶液の濃度換算の問題を解く際、多くの生徒が下のフレームを自分で書いて解く姿が見られました。

コメント&お問い合わせ承ります
この記事に関しまして何かご意見・ご質問・ご感想などがございましたら、当社サイトの右上にありますお問い合わせフォームよりコメントをお寄せください。
皆様のコメントは、この記事をご覧になっている先生方や、私自身にとってもこれからの授業づくりに有益になるものと思います。
また、この記事をご覧になっている高校理科の先生方の中には、こんなお悩みを抱えていらっしゃいませんか?
- これまでの授業で生徒の反応が思うように得られなかった。
- これからの授業で何をどう教えたらいいのかわからない。
- 教科横断型あるいは探究的な学びを授業で取り入れたい。
そんな先生方のために、高校理科の授業づくりやスケジューリングの支援事業を行っています。
この記事に関するコメントも含め、理科の授業や、お仕事のスケジューリングなどでお悩みなどがございましたら、ぜひお話をお聴かせください。
どんな些細なことでも構いませんので、当社サイトの右上にありますお問い合わせフォームよりコメントをお寄せください。
ここまでご覧いただきありがとうございました。
文責:滝沢