【化学基礎】酸と塩基の分類【授業実践備忘録】
前回に引き続き、今回は高校化学基礎での「酸と塩基の分類」をテーマに授業実践備忘録を綴っていきたいと思います。
酸と塩基は多種多様ですが、高校の化学基礎では、「価数」と「強弱」という2つの軸によって分類がされます。
酸と塩基の復習
授業の冒頭で、アレニウスの定義による酸と塩基の定義の確認を行い、電離の式を示しました。
酸と塩基の価数
塩酸と硫酸で比較すると、それぞれの化学式に含まれるHの数が異なります。
ということは、同じ濃度であっても電離して生じる水素イオンの量は塩酸と硫酸で変わってきます。
こうしたことから酸の価数について説明し、さらに塩基の価数についても説明を行いました。

酸と塩基の強弱
酸と塩基を水に溶かすと、完全に電離するものと一部しか電離しないものに分かれます。
物質が水に溶けて電離する割合を電離度といいます。

例えば同じ濃度の塩化水素(塩酸)と酢酸で比較すると、塩化水素分子は完全に電離して大量の水素イオンを生じます。
一方、酢酸分子は水に溶かした瞬間は完全に電離しますが、大半が下の酢酸分子としてくっつき、一部の酢酸分子のみが水素イオンを生じます。
そこから水に溶けて完全に電離する酸を強酸、一部のみ電離する酸を弱酸と分類します。
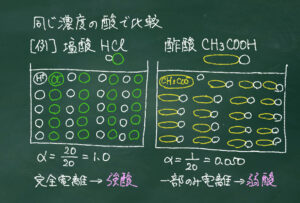
そこから、酸・塩基の強弱について、電離度と絡めながら整理しました。
教科書では強酸・弱酸・強塩基・弱塩基によって表で分類されていますが、すべてを覚える必要はありません。
種類を上げればキリがありませんが、化学基礎の範囲で、塩酸・硝酸・硫酸が強酸、アルカリ金属あるいはアルカリ土類金属(ベリリウム・マグネシウムを除く)の水酸化物が強塩基であることをのみを生徒に覚えるように指示しました。
(板書に示されているもの以外は弱酸・弱塩基になります)

これらをもとに、授業の冒頭で示した酸・塩基の電離の式に、価数と強弱を示しました。


授業実践の振り返り
教科書には同じ濃度の塩酸と酢酸に電気を流し、どれだけの明るさで電球が点灯するかを示されているものがあります。
生徒実験で生徒自身の目で確認してもらいたかったところですが、時間の都合上できませんでした。
実験をすることで、探究的な授業になったのではないかと悔やんでいます。
このときの後悔は、中和滴定の実験で同時に取り返したいと思います。
コメント&お問い合わせ承ります
この記事に関しまして何かご意見・ご質問・ご感想などがございましたら、当社サイトの右上にありますお問い合わせフォームよりコメントをお寄せください。
皆様のコメントは、この記事をご覧になっている先生方や、私自身にとってもこれからの授業づくりに有益になるものと思います。
また、この記事をご覧になっている高校理科の先生方の中には、こんなお悩みを抱えていらっしゃいませんか?
- これまでの授業で生徒の反応が思うように得られなかった。
- これからの授業で何をどう教えたらいいのかわからない。
- 教科横断型あるいは探究的な学びを授業で取り入れたい。
そんな先生方のために、高校理科の授業づくりやスケジューリングの支援事業を行っています。
この記事に関するコメントも含め、理科の授業や、お仕事のスケジューリングなどでお悩みなどがございましたら、ぜひお話をお聴かせください。
どんな些細なことでも構いませんので、当社サイトの右上にありますお問い合わせフォームよりコメントをお寄せください。
ここまでご覧いただきありがとうございました。
文責:滝沢


