【化学基礎】化学反応式②〜量的関係は係数が命〜【授業実践備忘録】
久々の授業実践の投稿になります。
今回は化学反応式に関する授業実践の続きになります。
この単元で特に重要なのは、反応式を正しく書くことだけでなく、そこから量的関係を正しく考えることだと思います。
反応式と量的関係について私の授業実践を綴って参ります。
化学反応式の書き方
化学反応式を書く際、次のようなルールがあります。

係数をもとにして量的関係を正しくつかむ
私の授業では、メタンが完全燃焼すると、二酸化炭素と液体の水が生じることを例に量的関係について考えています。
その際、次のような順番で指導をしています。


1.化学反応式を正しく書く
これまで化学反応式の書き方を復習する意味で、生徒には0から反応式を描いてもらっています。
2.係数の確認
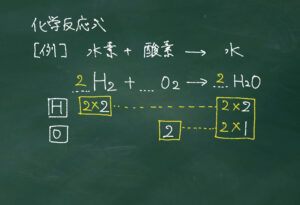
係数をもとに量的関係を考えていくので、量的関係の指導をする際は、係数比を反応式の下に必ず板書します。
3.粒子の個数
そもそも係数比が粒子の個数の比から考えられているので、係数の比が分かれば、未知の粒子の数が分かるようになります。
ただ、指導をする際、反応するメタン分子の数を1個、2個、10個⋯と少しずつ増やしていきながら、それぞれの場合で反応する酸素分子の数と、生成する二酸化炭素分子及び水分子の数を考えていきます。
その後で、物質量(mol)比とスムーズに繋がるように、6.0✕10²³個のメタン分子が完全燃焼したらどうなるかを考えます。
この粒子の個数を説明する際には、教える側も根気が必要です。
4.物質量
1molは6.0✕10²³個の粒子があつまってできた"おにぎり"として、物質量についてはすでに指導しています。
粒子の数の比は"おにぎり"の数の比と同じということで、反応式の係数の比はそのまま物質量の比になると説明しました。
5.気体の体積
アボガドロの法則より、1molの気体は種類を問わず、標準状態(0℃、1気圧)で22.4Lを占めることをすでに指導しています。
これを思い出すと、反応式中に出ていた気体の体積比は反応式の係数比になることがわかります。
ここまで説明した時点で、「係数比=個数比=mol比=(気体の)体積比」というまとめをしておきました。
実はこのフレーズ、五・七・五になっていることを強調して生徒に伝えたところ、楽しみながら覚えようとしている姿勢が伺えました。
6.質量
原子1個あたりの質量は元素によって異なるので、反応式の係数比は質量の比にそのまま対応していません。
それでもある物質の反応量から別の物質の反応量について考える場合、「質量はmolに直して考える」という五・七・五調のフレーズを伝え、その算出法についても示しました。
反応式から求められる反応量は「増減量」
ここで注意したいのは、反応式から求められる反応量は、物質の増減量であるということです。
つまり、反応物が減る量と、生成物が増える量を表しています。
実際の化学反応では過不足が生じることがつきもの。
教科書に記されている問題にも、過不足がある反応についても扱われています。
過不足がある反応については、どちらかが完全に反応してなくなったことを仮定して、次のようなバランスシート(増減表)を書いて考えることが必要になります。
しかし、多くの生徒の中では過不足なく物質は反応するという先入観に囚われているせいか、理解に追いつかないということがよく見られます。

コメント&お問い合わせ承ります
この記事に関しまして何かご意見・ご質問・ご感想などがございましたら、当社サイトの右上にありますお問い合わせフォームよりコメントをお寄せください。
皆様のコメントは、この記事をご覧になっている先生方や、私自身にとってもこれからの授業づくりに有益になるものと思います。
また、この記事をご覧になっている高校理科の先生方の中には、こんなお悩みを抱えていらっしゃいませんか?
- これまでの授業で生徒の反応が思うように得られなかった。
- これからの授業で何をどう教えたらいいのかわからない。
- 教科横断型あるいは探究的な学びを授業で取り入れたい。
そんな先生方のために、高校理科の授業づくりやスケジューリングの支援事業を行っています。
この記事に関するコメントも含め、理科の授業や、お仕事のスケジューリングなどでお悩みなどがございましたら、ぜひお話をお聴かせください。
どんな些細なことでも構いませんので、当社サイトの右上にありますお問い合わせフォームよりコメントをお寄せください。
ここまでご覧いただきありがとうございました。
文責:滝沢