【化学基礎】物質量③〜気体1molの体積〜【授業実践備忘録】
前回に引き続き、高校化学で学ぶ物質量についてまたもや投稿致します。
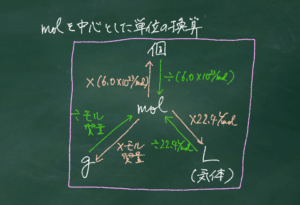
物質量(mol)=原子・分子・イオンを数多く集めてできた"おにぎり"を数える単位であり、1molの質量(モル質量)は原子量・分子量・式量にgをつけて示せます。
そこからさらに、気体1molの体積についてどのように扱うかについて、僭越ながら私の授業実践をご紹介致します。
アボガドロの法則と気体1molの体積
パンパンに膨れたゴムのボールの中には、一定量の空気(一定の数の気体分子)が含まれています。
そのゴムボールを握ると、中の空気の体積と圧力は変化しますが、分子の数は変わりません。
また、熱気球にも一定量の空気が含まれていますが、その空気をバーナーで加熱すると、分子の熱運動が激しくなり、体積が大きくなります。
このように、一定量の空気は温度・圧力によって体積が変化します。
このことは「アボガドロの法則」によってまとめられています。
しかし、化学においては、温度・圧力については一定の基準を定めないと気体の性質について考えにくい!
そこで、高校化学では0℃、1気圧(=1013hPa)、すなわち標準状態のもとで1molの気体の体積を22.4L/molと定めます。
ちなみに、この22.4Lというのは、バスケットボールと同じくらいの体積だそうです。
<余談>この22.4L/molは生徒には必ず覚えてもらっていますが、「2×2=4(ににんがし)」という語呂合わせを授業で紹介したところ、数名の生徒に爆笑されました(笑)

空気より”軽い”気体と”重い”気体は?
標準状態で気体1molの体積は22.4L/molというのをただ覚えるだけでは面白くないというのが本音。
これを使って、空気より”軽い”気体と”重い”気体がそれぞれどういうものなのかを私の授業では扱っています。
気体が空気より”軽い”か”重い”かは、空気の密度との比較になりますが、中学校1年の理科の授業で学んでいることです。
ただ、高校生になったらほとんどの生徒は忘れているので、復習がてら空気より”軽い”気体と”重い”気体に分類するワークを、私の授業では行っています。
その後、定量的な面から空気より”軽い”気体と”重い”気体が何かを解き明かしていきます。
そこでまずは、空気1molの質量について考えていきます。
空気は窒素80%、酸素20%の混合気体と仮定して、その平均質量を求め、1molの質量とします。

その気体が空気より”軽い”か”重い“かは密度によって決まりますので、密度の定義と求め方を示します。
その上で、いろいろな種類の気体の標準状態での密度を求め、空気より”軽い”か”重い“かを比較します。


コメント&お問い合わせ承ります
この記事に関しまして何かご意見・ご質問・ご感想などがございましたら、当社サイトの右上にありますお問い合わせフォームよりコメントをお寄せください。
皆様のコメントは、この記事をご覧になっている先生方や、私自身にとってもこれからの授業づくりに有益になるものと思います。
また、この記事をご覧になっている高校理科の先生方の中には、こんなお悩みを抱えていらっしゃいませんか?
- これまでの授業で生徒の反応が思うように得られなかった。
- これからの授業で何をどう教えたらいいのかわからない。
- 教科横断型あるいは探究的な学びを授業で取り入れたい。
そんな先生方のために、高校理科の授業づくりやスケジューリングの支援事業を行っています。
この記事に関するコメントも含め、理科の授業や、お仕事のスケジューリングなどでお悩みなどがございましたら、ぜひお話をお聴かせください。
どんな些細なことでも構いませんので、当社サイトの右上にありますお問い合わせフォームよりコメントをお寄せください。
ここまでご覧いただきありがとうございました。
文責:滝沢